
如果把生命比作一本精密运转的机器,那么DNA就是记录生命密码的原始代码库。这个代码库由A、T、C、G四个碱基字母构成的64组密码子(基础指令)组成,就像用26个字母拼写出所有英文单词一样。这些指令通过RNA传递给细胞,并利用20种标准氨基酸合成蛋白质。如果能够拓展这些基础指令,将从底层改写生命的法则,乃至发展全新的疗法。前人已经在DNA上进行了指令拓展的尝试;然而,对DNA密码的拓展在哺乳动物细胞中可能存在持续的终止密码子通读威胁,乃至产生不可预测的错误1。这促使研究者开始探索新的方向,试图突破传统遗传密码的边界。
作为信息传递的媒介,RNA不受DNA分子复制和损伤修复等存储功能的约束,能够更灵活地参与生命活动的调控。同时,RNA存在170多种修饰,这些丰富的化学修饰赋予了其更高的可塑性和功能性,为指令的创新提供了更多可能性。如今,科学家们通过创造全新的“RNA密码子”,成功改写了生命的底层逻辑,开发出一种超越64种天然遗传密码的全新编程语言。这一突破不仅拓展了生命的设计空间,也为精准医学、合成生物学等领域带来了新的机遇。
2025年6月25日,来自北京大学、北大-清华生命科学联合中心的陈鹏团队和伊成器团队合作在Nature发表题为RNAcodonexpansionviaprogrammablepseudouridineeditinganddecoding的论文,通过RNA假尿嘧啶Ψ修饰的定点编程,首次创造并编码了三个ΨCodon“密码子”,进一步筛选并获得了选择性解码ΨCodon的tRNA,在蛋白质的特点位点精准插入了非天然氨基酸,从而实现对蛋白质功能的操控。

RNA密码子拓展技术:编码和解码全新的RNA密码子
在这一工作中,作者创造的新RNA密码子突破了DNA的64种基础指令限制,通过指挥细胞利用非天然氨基酸合成蛋白质,开启了人工设计功能性生物大分子的全新维度。具体而言,作者首先采用序列特异性的Ψ修饰工具,利用向导RNA在目标转录本的终止密码子UGA上引入Ψ修饰2,3,生成带有Ψ修饰的全新密码子“ΨGA”(这类修饰的终止密码子统称为ΨCodon),从而实现对非天然氨基酸插入位点的精准编码(图1)。为了实现响应ΨCodon的特异性解码,作者基于公开的合成酶-tRNA晶体结构信息4,5,构建了饱和单点突变文库,筛选出兼具密码子偏好性与高效解码能力的tRNA变体(ΨGA-tRNAPyl)。该变体在多个报告系统中得到验证,以确保tRNA解码器对于ΨGA的特异性,使得其解码过程不影响其他转录本中UGA的天然翻译终止功能。结合这两个模块,作者完成了ΨGA的编码与解码,成功构建了RCE(ΨGA)系统。
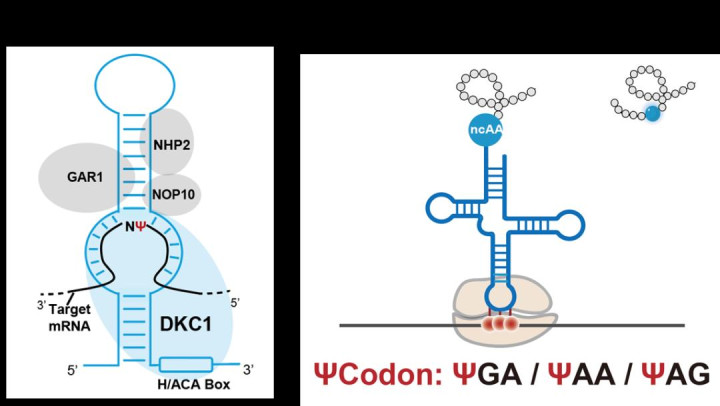
图1.RNA密码子拓展策略示意图。该策略包含编码(a)和解码(b)两个核心过程,从而实现非天然氨基酸的特异性插入。
RCE系统具有更高的全局特异性
在成功实现ΨGA密码子的编解码后,作者通过多种组学方式确定了RCE技术的全局特异性。为了在全转录组水平中检测编码的特异性,作者通过前期开发的Ψ测序方法“PRAISE”6,发现在全转录组范围内仅有少量的脱靶修饰,但并没有在正常的终止子上发生修饰。为了在翻译层面上检测ΨGA密码子的通读特异性,作者通过核糖体分析技术,在翻译组层面上评估了靶向序列和脱靶序列的通读效果(图2a)。结果显示,RCE系统可以实现对于靶向ΨGA密码子的有效翻译,同时全翻译组中UGA密码子的通读低于传统的遗传密码子拓展技术(GeneticCodeExpansion)。
作者进一步对RCE系统的翻译产物进行了全蛋白质组学分析。利用非天然氨基酸TetBu分子的四嗪基团,与反式环辛烯偶联的生物素分子的成键反应,从而基于生物正交反应进行全蛋白质组范围内的非天然氨基酸插入检测。蛋白质组学分析显示,在全蛋白组范围内,RCE系统的脱靶蛋白质种类也低于传统GCE策略,且GO分析表明其基本不干扰生物学通路(图2b)。
这三种组学检测方法均表明,RCE技术通过编解码Ψ修饰,可以有效实现序列特异性的非天然氨基酸插入,显著降低了脱靶效应。
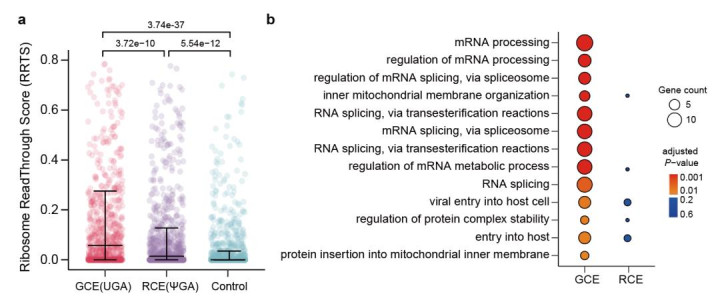
图2.翻译组分析(a)和蛋白质组分析(b)均显示RCE系统在全蛋白质组中具有全局特异性。
此外,作者进一步拓展了RCE系统的可用密码子范围。通过类似筛选ΨGA的tRNA解码器的方法,作者也筛选出针对ΨAA和ΨAG的特异性tRNA解码器。随后,作者验证了三种tRNA解码器两两正交,不会通读非其靶向的ΨCodon,说明每种ΨCodon的tRNA解码器均具有专一性。
RCE系统的应用
在功能实验方面,作者利用RCE系统精准引入具有断键和成键活性的非天然氨基酸,从而调控目的蛋白分子的定位及功能。以Src激酶为模型,作者通过在其催化活性中心插入反式环辛烯-赖氨酸(TCOK),构建了化学笼屏蔽型激酶突变体7。外源性添加四嗪(Tz)后,TCOK被剪切为天然赖氨酸8,激酶活性得以恢复(图3a)。实验证实,携带非天然氨基酸TCOK的tRNA解码器能够特异性通读ΨGA密码子,并通过免疫印迹和磷酸化蛋白质组学验证了Src的激活效果(图3b),证明RCE系统特异、高效地实现功能性非天然氨基酸的插入。最后,作者也证明了ΨAG及其tRNA解码器能够在保持高特异性的条件下,在p53蛋白质的关键入核序列中插入非天然氨基酸TCOK,以实现TP53入核的时空特异性化学操控。这进一步证明了RCE系统的通用性。这一工作不仅展示了RCE技术在精准蛋白质工程中的潜力,也为合成生物学和生物医学研究提供了全新的工具平台。
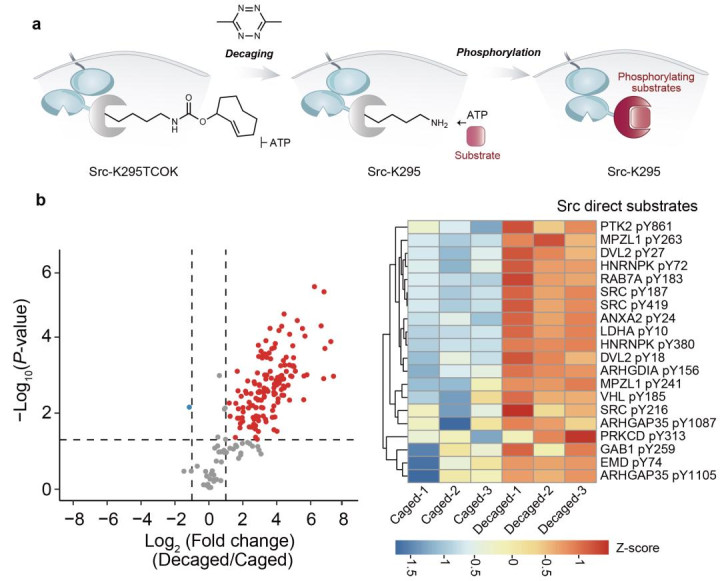
图3.RCE系统特异、高效地实现功能性非天然氨基酸的插入从而调控Src激酶活性。
综上所述,作者设计并建立了三种新型RNA密码子ΨCodon,验证了它们的有效性和特异性,同时也展示了该系统插入化学成键和断键活性的非天然氨基酸的能力。这一研究为遗传密码的改造提供了新的思路和工具,有望为设计人工合成生物体提供新的编解码元件。
北京大学、北大-清华生命科学联合中心陈鹏教授、伊成器教授为本文的共同通讯作者。本工作获得科技部、农业部、国家自然科学基金委、北京市科学技术委员会、北大-清华生命科学联合中心、北京大学核糖核酸北京研究中心、北京分子科学国家研究中心、新基石基金会和科学探索奖等项目的支持。北京大学前沿交叉学科研究院2019级博士研究生刘江乐、北京大学生命科学学院博士后闫学青博士、前沿交叉学科研究院2020级博士研究生乌浩为本文的共同第一作者。北京大学核糖核酸北京研究中心和北京科学智能研究院温翰研究员提供了核酸分子理论计算的专业指导意见;上海科技大学刘如娟课题组在核酸分子生化检测方面为本工作做出了重要贡献。
https://doi.org/10.1038/s41586-025-09165-x

陈鹏
北京大学化学与分子工程学院教授
北大-清华生命科学联合中心PI
研究领域:
致力于活细胞化学反应的开发与应用。系统建立了活细胞化学工具平台,提出并发展了“生物正交剪切反应”,突破了在活细胞内研究蛋白质功能的技术瓶颈,并应用于生命机制研究和蛋白质药物开发,开拓了生物正交反应新方向,为生命科学的研究和重大疾病的诊疗提供技术创新。具体研究方向如下:
生物正交反应:开发面向生命活体的化学反应与操纵技术;
蛋白质工程与组学:蛋白质工程、蛋白质组学、“时-空”多维组学;
免疫化学生物学:免疫系统中的细胞相互作用、功能机制调控及免疫治疗。

伊成器
北京大学生命科学学院教授
北大-清华生命科学联合中心PI
实验室主页:
yilab.org.cn
研究领域:
实验室致力于RNA/DNA修饰的生物学功能和机制研究,以及基因编辑新方法的开发。为了实现这一目标,我们综合运用包括化学生物学、表观遗传学、基因编辑和单细胞组学等多学科手段,旨在揭示核酸表观遗传修饰的新功能、发展RNA编辑的新技术。
1.RNA修饰和表观转录组学
几十年的研究已经鉴定了100多种转录后修饰。研究人员之前认为,一旦RNA修饰产生,这些共价修饰都是稳定存在、不可逆转的。然而,最近关于6-甲基腺嘌呤(m6A)的一系列研究证明,RNA甲基化也是动态可逆的,并且在基因表达调控中起到重要作用。因此,“表观转录组学”也随之兴起。
除了m6A,转录组上还存在其它表观遗传修饰。我们课题组最近的研究发现,多种之前认为只在非编码RNA上存在的转录后修饰,即假尿嘧啶(Ψ)1-甲基腺嘌呤(m1A)和m6Am,也广泛存在于哺乳动物的mRNA当中。我们的研究表明这些转录后修饰在转录组中广泛存在,受多种外界刺激的动态调控,并且动态、可逆。我们希望利用课题组已经开发的新颖表观转录组测序技术,来阐释这些RNA修饰在生理及病理条件下的功能和调控机制,从而在表观转录组学这个新兴起的学科中发现一片“新大陆”。
2.基因编辑
基因编辑作为新兴的颠覆式生物技术,已经在生物医药、农业、能源和生物安全等方面展现了巨大的潜力。本课题组发展了一系列现有基因编辑器的安全性评价技术,不仅为更精准的基因编辑工具的开放提供了关键参考,也为基因编辑用于临床治疗提供了重要依据。此外,由于DNA编辑会产生永久的“脱靶”编辑,我们也致力于新型RNA编辑技术的开发,有望获得更为精准、安全、便捷的基因编辑新技术。
3.DNA修饰和表观基因组学
哺乳动物基因组中,具有5-甲基胞嘧啶(5mC)、5-羟甲基胞嘧啶(5hmC)、5-醛基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC)等多种表观基因组修饰。本实验室开发了多个单碱基、单细胞水平上表观基因组的组学检测技术,未来将应用于单细胞测序和临床研究,以期鉴定疾病的生物标志物。此外,我们也关注染色质可及性的组学检测技术。
参考文献:略
